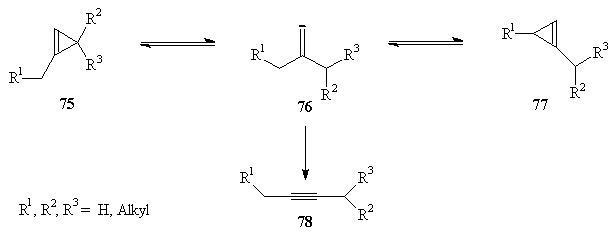
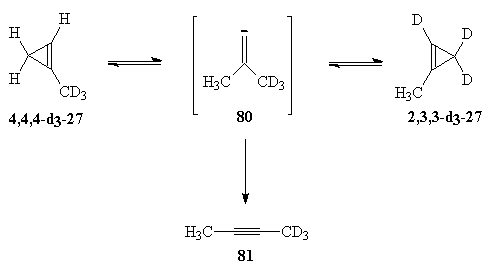
|
References
[1] H. A. Skinner, G. Pilcher, Quart. Rev. 1963,
17,
264-288.
[2] K. B. Wiberg, Angew. Chem. 1986,
98,
312-322; Angew. Chem. Int. Ed. Engl. 1986, 25, 809-826.
[3] G. L. Closs, Cyclopropenes in Adv. Alicycl.
Chem., Vol. 1 (Hrsg.: H. Hart, G. J. Karabatsos) 1966, S. 53-127.
[4] M. L. Deem, Synthesis 1982, 701-716.
[5] M. S. Baird, C. M. Dale, W. Lytollis, M. J. Simpson,
Tetrahedron
Lett. 1992, 1521-1522.
[6] L. N. Li, H. Li, R. W. Lang, T. Itoh, D. Sica,
C. Djerassi, J. Am. Chem. Soc. 1982, 104, 6726-6732.
[7] [7a] H. Hopf, A. Plagens, R. Walsh, J.
Chem. Soc., Chem. Commun. 1994, 1467-1468.
[7b] H. Hopf, A. Plagens, R. Walsh, Liebigs
Ann. 1996, 825-835.
[8] I. R. Lithotvorik, D. W. Brown, M. Jones, J.
Am. Chem. Soc. 1994, 116, 6175-6178.
[9] K. B. Wiberg, W. I. Bartley, J. Am. Chem. Soc.
1960,
82,
6375-6380.
[10] R. Srinivasan, J. Chem. Soc., Chem Commun.
1971,
1041-1042.
[11] M. Yoshimine, J. Pacansky, N. Honjou, J.
Am. Chem. Soc. 1989, 111, 4198-4209.
[12] R. Walsh, C. Wolf, S. Untiedt, A. de Meijere,
J.
Chem. Soc., Chem. Commun. 1992, 421-422.
[13] H. Hopf, G. Wachholz, R. Walsh, Chem. Ber.
1985,
118,
3579-3587.
[14] M. S. Baird, Functionalised Cyclopropenes as Synthetic Intermediates
in Top. Curr. Chem., Vol. 144 (Hrsg.: A. de Meijere), Springer-Verlag,
Berlin, 1988, 137-154.
[15] W. R. Bamford, T. R. Stevens, J. Chem. Soc. 1952,
4735-4740.
[16] G. L. Closs, L. E. Closs, W. A. Böll, J. Am. Chem. Soc.
1963,
85,
3796-3800.
[17] R. Köster, S. Arora, P. Binger, Liebigs Ann. Chem.
1973,
1219-1235.
[18] G. L. Closs, L. E. Closs, J. Am. Chem. Soc. 1963,
85,
99-104.
[19] S. Arora, P. Binger, R. Köster, Synthesis 1973,
146-148.
[20] P. Binger, Synthesis 1974, 190-192.
[21] M. S. Baird, W. Nethercott, Tetrahedron Lett. 1983,
24,
605-608.
[22] M. S. Baird, H. H. Hussain, W. Nethercott, J. Chem. Soc., Perkin
Trans. 1 1986, 1845-1853.
[23] M. S. Baird, H. L. Fitton, W. Clegg, A. McCamley, J. Chem.
Soc., Perkin Trans. 1 1993, 321-326.
[24] R. Boese, D. Bläser, W. E. Billups, M. M. Haley, W. Luo,
B. E. Arney, J. Org. Chem. 1994, 59, 8125-8126.
[25] M. M. Haley, B. Biggs, W. A. Looney, R. D. Gilbertson, Tetrahedron
Lett. 1995, 36, 3457-3460.
[26] M. B. Green, W. J. Hickinbotton, J. Chem. Soc. 1957,
3262-3270.
[27] M. F. Hawthorne, J. Am. Chem. Soc. 1960, 82,
1886-1888.
[28] H. Dürr, Chem. Ber. 1970, 103, 369-379.
[29] P. Dowd, A. Gold, Tetrahedron Lett. 1969, 2,
85-86.
[30] M. S. Baird, W. Nethercott, P. D. Slowey, J. Chem. Res. (M)
1985,
3815-3829.
[31] E. V. Dehmlow, J. Wilkenloh, J. Chem. Res. (S) 1984,
396-397.
[32] W. von E. Doering, P. M. LaFlamme, Tetrahedron 1958,
2,
75-79.
[33] J. M. Walbrick, J. W. Wilson, W. M. Jones, J. Am. Chem. Soc.
1968,
90,
2895-2901.
[34] G. L. Closs, L. E. Closs, J. Am. Chem. Soc. 1960,
82,
5723-5728.
[35] F. A. Lindemann, Trans. Faraday Soc. 1922, 17,
598.
[36] [36a] C. N. Hinshelwood, Proc. Roy. Soc. 1926,
113A,
230-233.
[36b] O. K. Rice, H. C. Ramsperger, J. Am. Chem. Soc.
1927,
49,
1617-1629.
[36c] L. S. Kassel, J. Phys.Chem. 1928, 32,
225-242.
[37] K. Schwetlick, Chemische Kinetik, Verlag für Grundstoffindustrie,
Leipzig, 1982.
[38] H. Eyring, J. Chem. Phys. 1935, 3, 107-115.
[39] [39a] C. W. Gear, Numerical Initial
Value Problems in Ordinary Differential Equations, Prentice Hall, Englewood
Cliffs, New Jersey, 1971.
[39b] C. W. Gear in Information Processing, Vol.
1 (Hrsg.: A. Morell), North Holland, Amsterdam, 1969, S. 187ff.
[39c] A. Jones, Recent Advances in the Analysis of Kinetic
Data, in A Specialist Periodical Report, Reaction Kinetics, Vol. 1
(Hrsg.: P. G. Ashmore), The Chemical Society, London, 1974.
[39d] R. D. Grigorieff, Numerik gewöhnlicher Differentialgleichungen
Band 2, Teubner, Stuttgart, 1977, S. 90 ff., S. 236 ff.
[39e] Weitere Beispiele zur Anwendung des Gear-Algorithmus
bei der Ermittlung von Gasphasen-Kinetiken finden sich in: H. Hopf, G.
Wachholz, R. Walsh, A. de Meijere, S. Teichmann, Chem. Ber. 1989,
122, 377-382, H. Hopf, G. Wachholz, R. Walsh, Chem. Ber. 1992,
125,
711-721, G. McGaffin, Dissertation, Universität Hamburg,
1993.
[40] E. J. York, W. Dittmar, J. R. Stevenson, R.
G. Bergman, J. Am. Chem. Soc. 1973, 95, 5680-5687.
[41] J. P. Chesick, J. Am. Chem. Soc. 1963, 85,
2720-2722.
[42] H. M. Frey, Trans. Faraday Soc. 1962, 58,
957-960.
[43] D. D. Perrin, W. L. F. Armarego, Purification of Laboratory
Chemicals, 3rd Ed., Pergamon Press, Oxford, 1988.
[44] L. Brandsma, Preparative Acetylenic Chemistry, Elsevier
Publishing Company, Amsterdam 1971, S.19.
[45] Da Kopplungskonstanten von 1H-NMR-Spektren sowie z.T. MS-, IR-
und 13C-NMR-Spektren in der Literatur nicht vollständig angegeben
sind, wurden entsprechende spektroskopische Daten trotz bekannter Literaturdaten
in dieser Arbeit vollständig wiedergegeben.
[46] [46a] C. S. Chin, B. Lee, S. Kim, J. Chun, J. Chem. Soc.,
Dalton Trans. 1991, 443-448.
[46b] J. G. Dubondin, B. Jousseaume, J. Organomet. Chem.
1979,
168,
1-11.
[47] S. Boué, R. Srinivasan, J. Am. Chem. Soc. 1970,
92,
1824-1828.
[48] D. F. Koster, A. Danti, J. Phys. Chem. 1965, 69,
486-491.
[49] [49a] W. Runge, J. Firl, Ber. Bunsen Ges. Phys. Chem.
1975,
79,
913-922.
[49b] J. M. Curtis, A. G. Brenton, J. H. Beynon, R. K.
Boyd, Org. Mass Spectrom. 1987, 22, 779-789.
[50] Zur Identifizierung der Pyrolyseprodukte wurden die spektroskopischen
Daten trotz z.T. bekannter Literaturdaten vollständig angegeben.
[51] [51a] K. Banert, Chem. Ber. 1987, 120,
1891-1896.
[51b] C. M. Adams, G. Cerioni, A. Hafner, H. Kalchhauser,
W. v. Phillipsborn, R. Prewo, A. Schenk, Helv. Chim. Acta 1988,
71,
1116-1142.
[52] R. S. Mason, K. R. Jennings, S. Verma, R. G. Cooks, Org. Mass
Spectrom. 1985, 20, 727-732.
[53] [53a] E. V. Dehmlow, M. Lissel, Liebigs Ann. Chem.
1980,
1-13.
[53b] C. A. Tsipis, J. Organomet. Chem. 1980,
188,
53-62.
[53c] W. Wagner-Redeker, K. Levsen, Org. Mass Spectrom.
1981,
16,
538-541.
[54] L. Batt, Experimental Methods for the Study of Slow Reactions,
in Comprehensive Chemical Kinetics, Vol. 1 (Hrsg.: C. H. Bamford, C. F.
H. Tipper), Elsevier, Amsterdam, 1969, S. 1-111.
|